Axit các loại
-
ACID FORMIC HCOOH
Quy cách: 35 kg/canLiên hệAxit fomic thuộc nhóm axit cacboxylic. Công thức hoá học là HCOOH và là thành viên đầu tiên của nhóm axit cacboxylic. Axit fomic còn được gọi là axit metanoic.
-
Axit Malic- C4H6O5
Quy cách: 25kg/baoLiên hệAxit Malic là hợp chất hữu cơ tạp chức, có chứa cả hai nhóm chức là carboxyl (COOH) và nhóm hydroxyl (OH). Chính vì vậy nên Axit Malic có tính chất của một Axit và những phản ứng đặc trưng của nhóm chức.
-
Axit Stearic C18H36O2
Quy cách: 25kg/baoLiên hệAxit Stearic được sử dụng trong công nghiệp sản xuất xà phòng, chất tẩy rửa, mỹ phẩm, dầu gội, …Axit Stearic được este hóa rồi thêm vào quá trình sản xuất ở dạng lỏng để kiểm soát độ kết tinh và tạo hiệu ứng màu ngọc trai, làm đông cứng cho các sản phẩm.
-
Axit Tartaric C4H6O6
Quy cách: 25kg/baoLiên hệAxit tartaric và các dẫn xuất của nó có rất nhiều công dụng trong lĩnh vực dược phẩm. Ví dụ, nó đã được sử dụng trong sản xuất muối sủi bọt, kết hợp với axit citric, để cải thiện hương vị của thuốc uống.
-
Axit Sulfamic
Quy cách: 25kg/baoLiên hệAxit sulfamic có ứng dụng trong sự tổng hợp của các hợp chất có vị ngọt. Phản ứng với cyclohexylamine tiếp theo là bổ sung NaOH cho C6H11NHSO3, natri cyclamate.
-
Axit Oxalic C2H2O4
Quy cách: 25kg/baoLiên hệAxit oxalic có rất nhiều ứng dụng trong các ngành khách nhau như: chế tạo acheomycin, terramycin and borneol trong ngành dược, chế tạo dung dịch tẩy rửa các thiết bị điện, dùng trong việc kết tủa và phân tách kim loại đất hiếm.
-
Axit Citric- Axit chanh C6H8O7, Trung Quốc
Quy cách: 25kg/baoLiên hệAxit citric hay còn được gọi là axit chanh có công thức là C6H8O7, nó là axit hữu cơ yếu, có ứng dụng trong chất bảo quản, dùng để bổ sung vị chua cho thực phẩm và nước ngọt.
-
Axit axetic CH3COOH 99.85%
Quy cách: 30kg/canLiên hệAxit axetic CH3COOH là axit hữu cơ được sử dụng tronng công nghiệp để sản xuất các hợp chất hóa học khác nhau như axetic anhydrite và ester ngoài ra còn được sử dụng để sản xuất giấm và dùng trong phòng thí nghiệm.
-
Axit Boric H3BO3
Quy cách: 25kg/baoLiên hệAxit Boric H3BO3 (acid boric) được tổng kho hóa chất Việt Nam cung cấp với trữ lượng lớn , chất lượng cao, giá thành rẻ , an toàn dễ sử dụng ….
Chi tiết liên hệ : Facebook: tổng kho hóa chất , Hotline : 0911 481 823 .
-
Axit flohydric HF 55%, Trung Quốc
Quy cách: 25kg/canLiên hệAxit flohydric có công thức hóa học là HF. Đây là axit có nhiều ứng dụng trong nghệ được ứng dụng trong công nghiệp lọc hóa dầu, công nghiệp phá đá và làm sạch những ăn mòn..
-
Axit Nitric HNO3 68%, Hàn Quốc
Quy cách: 35kg/canLiên hệAxit Nitric HNO3 là axit có tính oxy hóa mạnh, là chất lỏng không màu, bốc hơi mạnh trong không khí, tỏa khói trong môi trường không khí ẩm. Nếu để HNO3 trong thời gian dài axit sẽ hóa vàng do tích tụ các oxit của Nitơ.
-
Axit phosphoric H3PO4 85%
Quy cách: 35kg/canLiên hệTổng kho hóa chất Việt Nam cung cấp Axit photphoric chất lượng đảm bảo , uy tín hàng đầu , giá thành rẻ , vận chuyển toàn quốc …
-
Axit sunfuric H2SO4 98% Công nghiệp
Quy cách: 40 kg/can, 250 kg/phuyLiên hệAxit Sunfuric H2SO4 được sử dụng với tỷ lệ khác nhau tuỳ theo ngành sản xuất và thiết bị máy móc, công nghệ. Là loại hoá chất nguy hiểm, tiếp xúc da gây bỏng cháy nặng.
-
Axit clohydric HCl 30%, Việt Nam
Quy cách: 30kg/can, 250kg/phuyLiên hệAxit clohydric 30% được tổng kho hóa chất Việt Nam cung cấp với chất lượng cao , uy tín hàng đầu , giá thành cực tốt… Ngoài ra còn rất nhiều ưu đã khác.
Đối với lĩnh vực hóa học nói riêng và đời sống nói chung, axit đóng vai trò cực kỳ quan trọng, được ứng dụng nhiều để phục vụ con người. Muốn chứng minh hay giải thích các hiện tượng phát sinh trong hóa học, chúng ta đều cần đến axit. Vậy, axit là gì? Công thức của các loại axit ra sao?Do đó, việc tìm hiểu axit là vô cùng cần thiết.
Tổng quan về Axit
Axit và công thức của axit là gì?
1 chất đều chứa 1 hay nhiều nguyên tử Hidro liên kết với gốc axit trong thành phần phân tử được gọi là 1 hợp chất hóa học – tên axit (ví dụ: -CL, =SO4. -NO3).
Ngoài ra, chúng ta có thể tham khảo thêm các định nghĩa khác về Axit:
- Axit là một hợp chất hóa học có thể tạo ra dung dịch có nồng độ pH < 7. Khi hòa tan cùng nước, axit có vị chua. Độ pH càng lớn thì tính axit càng yếu và ngược lại.
- Axit là các phân tử hay ion có khả năng nhường proton H+ cho Bazo hoặc nhận các cặp Electron không chia từ Bazo.
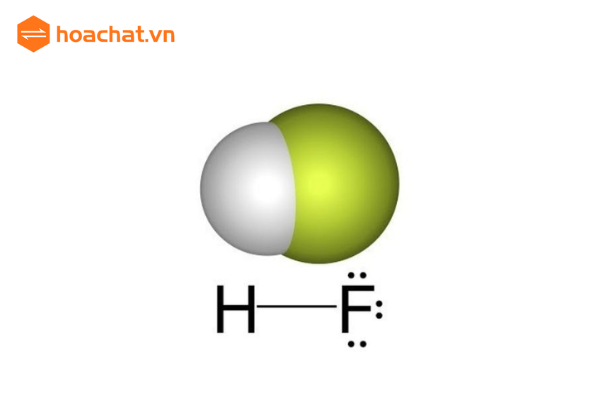
Công thức cấu tạo của axit flohydric
Phân loại axit
Việc phân loại axit dựa vào các tiêu chí như sau:
- Theo tính chất hóa học :
Axit mạnh: Axit này khi hòa tan vào nước sẽ tạo thành dung dịch có độ pH nhỏ hơn 7 rất nhiều. Axit càng mạnh khi nó có độ pH càng nhỏ .
Ví dụ: HCL, HNO3, H2SO4…
Axit yếu: khi hòa tan vào nước, axit yếu sẽ tạo thành dung dịch có độ pH gần 7 hơn.
Ví dụ: H2S. H2CO3,…
- Theo nguyên tử Oxi:
Axit có Oxi: H2SO4, HNO3,H3PO4, H2CO3,H3NSO3…
Axit không có Oxi: HCL, H2S, HBr, HL, HF,…
- Ngoài ra, ta còn một số các tiêu chí phân loại khác:
Axit vô cơ: HCL, H2SO4, Axit nitric,…
Axit hữu cơ (-RCOOH): CH3COOH, HCOOH, Axit chanh
Các kim loại ở dạng Hidrat hóa: Al(H2O)3 3+, Cu(H2O)2 2+,…
Các Ion: H+, H3O+, NH4+,…
Tính chất của axit
Tính chất hoá học
- Làm thay đổi màu quỳ tím
Dung dịch axit làm đổi màu giấy quỳ tím thành đỏ.
Bởi vậy, đây là một trong những cách để nhận biết dung dịch axit.
- Tác dụng với kim loại:
Khi cho dung dịch axit tác dụng với các kim loại đứng trước nguyên tử H trong dãy hoạt động hóa học, ta sẽ nhận được 1 muối và giải phóng khí Hidro. (Nếu axit đặc thì sẽ không giải phóng khí Hidro)
Ví dụ: 2Na + 2HCL -> 2NaCl + H2
Fe + 2HCl -> FeCl2 + H2
- Tác dụng với Bazơ
Khi cho dung dịch Axit tác dụng với các Bazơ thì phản ứng sẽ xảy ra mãnh liệt và ta sẽ nhận được 1 muối và nước.
Ví dụ: NaOH + HCl -> NaCl + H2O
Mg(OH)2 + 2HCl -> MgCl2 + 2H2O
- Tác dụng với Oxit Bazơ
Tất cả các Axit đều tác dụng với Oxit Bazơ vào tạo thành muối + nước.
Ví dụ: Na2O + 2HCl -> 2NaCl + H2
FeO + H2SO4(loãng) -> FeSO4 + H2O
- Tác dụng với muối
Khi Axit tác dụng với muối sẽ tạo ra các trường hợp sau:
Chất tạo thành có ít nhất 1 kết tủa hoặc 1 khí bay hơi.
Nếu axit mạnh, sau phản ứng, muối mới được tạo ra sẽ là là muối tan. Ngược lại, phản ứng sẽ tạo ra muối không tan nếu dung dịch axit mạnh.
Ví dụ: H2SO4 + BaCL2 -> BaSO4(r) + 2HCl
K2CO3 + 2HCl -> 2KCl + H2O + CO2 (H2CO3 phân hủy ra H2O và CO2)
Tính chất vật lý
- Tan trong nước, có vị chua.
- Khi tiếp xúc với axit mạnh, ta sẽ có cảm giác đau nhói.
- Có thể dẫn điện do bản thân axit chính là chất điện li.
Axit formic
Cách xác định độ mạnh, yếu của axit
Độ mạnh yếu của axit được xác định dựa vào sự linh động của nguyên tử Hydro trong cấu tạo của nó. Nếu nguyên tử Hidro càng linh động thì tính axit càng mạnh và ngược lại.
Đối với những axit có Oxy trong cùng 1 nguyên tố, càng ít Oxy, tính axit càng yếu.
HCLO4 > HCLO3 > HCLO2 > HCLO
Đối với những axit của nguyên tố trong cùng chu kỳ, khi các nguyên tố ở hóa trị cao nhất, nguyên tố trung tâm có tính phi kim càng yếu thì axit đó càng yếu.
HCLO4 >H2SO4 > H3PO4
Khi nguyên tố chứa axit cùng nhóm A, ta có:
- Cấu tạo có Oxy: Tính Axit giảm dần từ trên xuống: HCLO4 > HbrO4 > HIO4
- Cấu tạo không có Oxy: Tính Axit tăng dần từ trên xuống: HF < HCL < HBr < HI
Đối với axit hữu cơ RCOOH:
- Tính axit giảm khi gốc R no (nếu R đẩy electron)
n-C4H9COOH < CH3CH2CH2COOH < CH3CH2COOH < CH3COOH < HCOOH
- Nếu R hút e (gốc R không no, thơm hoặc có nguyên tố Halogen,…) tính axit sẽ mạnh.
>>Tham khảo: Axit Oxalic
Ứng dụng của axit trong đời sống
Ngày nay, người ta sử dụng axit để phục vụ các lĩnh vực sản xuất, công nghiệp… Dưới đây là một số ứng dụng tiêu biểu của axit
Trong công nghiệp:
- Thường được sử dụng để loại bỏ gỉ sắt và sự ăn mòn khác từ kim loại trong quá trình sản xuất. Qúa trình này được gọi là tẩy.
- Chúng có thể được sử dụng như 1 chất điện trong pin, chẳng hạn như axit Sunfuric trong pin xe hơi.
- Axit Nitric phản ứng với Ammonia để tạo ra Amoni Nitrat, 1 phân bón. Ngoài ra, este có thể được tạo ra khi este hóa rượu cồn với axit Cacboxylic.
Trong công nghiệp chế biến:
Do axit phục vụ như chất bảo quản (chúng làm thay đổi khẩu vị) nên hay được sử dụng làm chất phụ gia cho thực phẩm và đồ uống.
>>Tham khảo: Axit citric mono
Trong dược học:
Một số axit được sử dụng làm thuốc. Axit Acetylsalicylic (Aspirin) được sử dụng như 1 thuốc giảm đau và làm giảm cơn sốt. Axit đóng vai trò quan trọng trong cơ thể con người.
Đối với cơ thể con người:
- – Các phân tử thức ăn lớn, phức tạp trong dạ dày sẽ bị phá vỡ và tiêu hóa bởi axit Clohidric.
- – Amino axit được yêu cầu tổng hợp các Protein cần thiết cho sự phát triển và sửa chữa các mô cơ thể.
- – Các mô của cơ thể cũng cần được sửa chữa và phát triển bởi axit béo. Các axit Nucleic rất quan trọng cho việc sản xuất DNA, RNA và chuyển các đặc tính sang con lai qua gen. Axit Cacbon rất quan trọng để duy trì độ cân bằng pH trong cơ thể.
Axit clohydric
Các loại axit phổ biến nhất
Axit Clohidric (HCL)
Các tính chất của 1 axit mạnh được hội tụ đầy đủ trong HCl. Dung dịch HCl đậm đặc là dung dịch bão hòa Hidro Clorua, có nồng độ khoảng 3%. Tùy vào hạn mức pha chế mà ta có các dung dịch HCl với nồng độ khác nhau.
HCl có những ứng dụng như:
- Điều chế các muối Clorua
- Bề mặt kim loại được HCL làm sạch trước khi hàn
- Trước khi sơn, tráng, mạ kim loại thì HCL sẽ giúp tẩy gỉ kim loại
>>Tham khảo: Axit Citric
Axit Sunfuric (H2SO4)
Axit H2SO4 là axit có các đặc tính như:
- Có chất lỏng sánh
- Không màu
- Có độ nặng gấp đôi độ nặng của nước và tan dễ dàng trong nước
- Không bay hơi
- Tỏa nhiều nhiệt
- Một số H2SO4 có dạng đậm đặc
Axit H2SO4 loãng và Axit H2SO4 đặc có những tính chất hóa học khác nhau. Tuy nhiên, hầu hết các tính chất của axit sunfuric được biểu hiện rất mạnh mẽ. Chúng được dùng để làm nguyên liệu của ngành sản xuất hóa học như: phân bón, chế biến dầu mỏ, phẩm nhuộm,…
Hy vọng với bài khái quát trên, tổng kho hóa chất chuyên kinh doanh hóa chất đã cho các bạn có thể hiểu rõ hơn về axit để có thể nhận dạng và sử dụng chúng 1 cách tốt nhất, phù hợp nhất!





















